
BURLINGAME, Calif., Nov 22, 2021 - (ACN Newswire) - 자사의 주력 약제 후보인 렌질루맙(Lenzilumab)으로 사이토카인 폭풍이라고 지칭되는 면역과잉반응을 예방하고 치료하는 것에 초점을 둔 임상 단계 바이오제약사, 휴머니젠(Humanigen, Inc., Nasdaq: HGEN)은 오늘 기업 및 규제 관련 업데이트 내용을 제공하고 3분기 및 2021년 9월 30일에 종결되는 9개월간의 재무 결과를 보고했다.
영국 의약품규제청(Medicines and Healthcare Products Regulatory Agency, MHRA) 판매승인 신청 진행 현황
휴머니젠은 2021년 6월 11일 영국 의약품규제청(MHRA)으로부터 코로나19 입원환자 대상의 렌질루맙 사용 조건부판매승인(CMA)을 받기 위한 신청서 제출을 개시했으며 2021년 7월9일에 사전검토 가속화 승인을 받았다. 이후 2021년 9월 30일에 계획된 모듈 중 마지막 모듈의 제출을 마쳤다. 자사는 MHRA 측에서 자사가 제출한 신청 내용을 적극적으로 검토하고 있는 것으로 판단하고 있다.
"휴머니젠은 코로나19 입원 환자를 대상으로 렌질루맙 치료제를 사용하기 위한 노력을 이어가고 있다. 최근 유럽집행위원회(European Commission)에서 가장 효과적인 코로나19 치료제로 예상되는 의약품 10종에 렌질루맙을 포함시키면서 렌질루맙이 지닌 임상적 잠재성이 상당한 것으로 판단한 자사의 판단이 옳았음을 증명했다.1 휴머니젠은 자사의 신청 내역을 검토하겠다는 결정을 내린 MHRA의 노력에 감사를 표하는 바이다."라고 카메론 듀란(Cameron Durrant) 휴머니젠 CEO가 전했다. "영국의 백신 접종율은 79%에 달하지만 코로나19에 따른 입원은 여전히 이어지고 있습니다. 휴머니젠은 환자들에게 본 치료법을 잠재적으로 제공하기 위해 영국과 미국, 유럽연합 내 규제 기관과 협업을 이어가고 있다."2
최근 데이터에 따르면 백신 접종을 완료한 이들은 감염되지 않으며 중증도가 시간에 따라 감소하고 코로나19 감염 이후 심각한 환후를 보인 환자들을 위한 추가적인 치료법을 고안하기 위한 노력이 이어지고 있다. 3 영국 내에서 약 80%에 가까운 인구가 백신 접종을 완료했지만 10월 한 달 동안에만 병원에 새롭게 입원한 코로나19 환자가 2만 5천명에 달하며 이는 백신 접종을 완료한 인구의 50%를 넘는 수치에 해당한다. 2, 4, 5
휴머니젠의 티모시 모리스(Timothy Morris) 최고운영책임자(COO) 겸 최고재무책임자(CFO)는 다음과 같이 전했다. "자사에서는 렌질루맙을 영국 내 병원에 수입 및 출시, 유통하기 위한 공급망을 갖추어 MHRA로부터 승인을 얻을 경우 영국에서의 상품 출시를 대비하고 있다. 이와 별도로 클리니젠(Clinigen)사와 맺은 협약을 실행에 옮긴다면 규제에 따라 제한된 접근권 사용 및 지정된 환자 사용, 동정적 사용이 허용되는 유럽연합 소속의 16개국 환자들에게 렌질루맙을 유통할 수 있을 것이다. 자사는 또한 만성골수단구성백혈병(Chronic Myelomonocytic Leukemia, CMML) 및 급성이식편대숙주병(acute Graft versus Host Disease, aGvHD) 등의 질환에 적용될 경우에 렌질루맙의 효능을 평가하는 과정과 판매 승인을 얻은 비호지킨림프종(non-Hodgkin lymphoma)의 CD19 CAR-T 치료법에 대한 임상 3상 실험을 수행하는 과정이 진척을 보여 매우 기쁘다.”
3분기 및 최근의 성과
코로나19 입원 환자를 위한 렌질루맙 치료제
- 유럽 집행위원회(European Commission), 휴머니젠의 렌질루맙을 가장 효과적인 코로나19 치료제로 예상되는 의약품 10종에 포함시키기로 결정.
- 영국 의약품규제청으로부터 코로나19 환자 대상 렌질루맙 치료제의 조건부판매승인(CMA)를 획득하기 위한 최종 필수 모듈 및 위험관리계획, 유소아조사계획 제출.
- 유럽의약품기구(EMA), 자사의 유럽연합 내 코로나19 대상 렌질루맙의 판매사용승인(MAA) 계획 제출 서류에 관련된 조사위원 및 공동조사위원 임명.
- 최대 16개국 유럽 국가에서 각 사례에 따라 환자군 대상의 렌질루맙 접근권에 있어 제한된 접근권 사용 프로그램 설립을 골자로 한 클리니젠과외 협약을 체결.
- FDA 측에 B 형 면담 요청 후 수락 받음. 면담 요청서에는 60일치 데이터뿐만 아니라 자사의 라이브에어 임상 3상 연구를 통한 상세한 CRP 분석이 포함됨.
CMML 및 aGvHD, NHL 등 질환 대상의 렌질루맙
- 호주 내 파트너사의 후원을 받아 만성골수단핵구성백혈병(CMML)환자 대상의 렌질루맙 임상2상 단계에서 첫 환자 투약.
- 영국 전역에 존재하는 IMPACT 파트너십 줄기세포 이식 센터에서의 aGvHD 치료 시 렌질루맙 효능 평가를 위한 잠재적 등록 임상 2상 및 3상 연구 수행을 골자로 한 협약을 버밍엄 대학교와 체결.
- FDA 측과 NHL 치료 시 사용되는 CD19 CAR-T 치료법의 안전성 및 효능을 개선하기 위한 무작위 위약대조 개방형 다중심 임상 3상 실험 수행 프로토콜 논의 목적으로 2021년 9월 회의 일정을 구성.
법인
- 이사회 구성원으로 존 호네커 박사와 케빈 씨에 박사 선출.
- GM-CSF 억제제를 활용하여 CAR-T 세포 치료 시 유도되는 신경 독성 치료법을 보호하는 미국 특허 번호 11,130,805 취득. 해당 특허는 2021년 9월 28일에 발행된 것이며 예정된 바에 따르면 2038년 10월 2일까지 특허 기간 지속.
ACTIV-5 업데이트 사항
2021년 8월, 미국 국립보건원(National Institutes of Health; NIH)은 통칭 ACTV-5/BET-B로 지칭되는 코로나19 치료적 중재 및 백신 가속화(Accelerating COVID-19 Therapeutic Interventions and Vaccines; ACTIV-5) 파트너십과 Big Effect Trial B군(BET-B) 실험의 진전 현황을 발표했다. 자사로부터 후속 피드백을 받고 논의를 이어간 미 국립보건원은 기초 CRP 수치 150mg/L 이하인 환자 최대 400명 혹은 총 환자 최대 550명까지 등록을 목표로 연구를 임상 2/3상 단계까지 진행했으며 자사의 라이브에어(LIVE-AIR) 실험의 설계와 대칭되는 방향으로 ACTIV-5/BET-B 프로토콜을 수정했다. 해당 실험에는 목표치의 75%에 해당하는 환자가 등록을 마친 상태이다.
3분기 및 2021년 9월 30일 종료 9개월 기간의 재무 성과
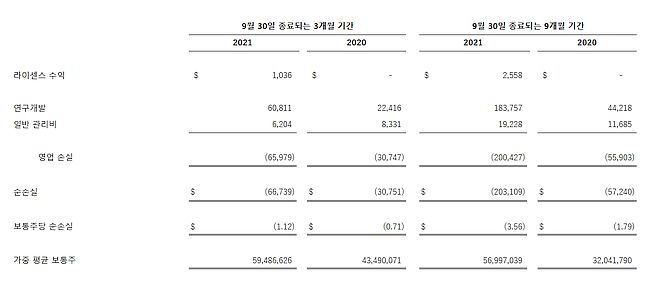
2021년 9월 30일을 종료 일자로 하는 3개월 동안 순 손실은 6,670만 달러였고 주당 가격은 1.12달러로 2020년 9월 30일을 종료 일자로 하는 3개월 동안의 순 손실 3,080만 달러 및 주당 가격 0.71달러와 대비된다. 2021년 9월 30일을 종료 일자로 하는 9개월 기간에 해당하는 순 손실은 2억 310만 달러에 주당 가격은 3.56달러로, 2020년 9월 30일을 종료 일자로 하는 9개월 동안의 순 손실 5,720만 달러 내지 주당 가격 1.79달러와 대비된다. 두 기간 동안의 순 손실 증가는 주로 총 비용이 증가했다는 점에서 기인한 바가 크며, 총 비용 증가의 주된 영향을 미친 것은 연구 개발 비용으로, 자사에서 규제 승인 취득에 따른 잠재적 상업화를 대비해 렌질루맙의 생산 노력을 가속화함에 따라 대폭 상승하는 추세를 보였던 항목에 해당한다. 연구개발비용은 2020년 9월 30일을 종료 일자로 하는 3개월 기간에 기록한 2,240만 달러에서 3,840만 달러 증가하여 2021년 9월 30일을 종료 일자로 하는 3개월 기간에는 6,080만 달러에 달했으며 2020년 9월 30일을 종료 일자로 하는 9개월 기간에 기록한 4,420만 달러에서 1억 3,960만 달러 증가하여 2021년 9월 30일을 종료 일자로 하는 9개월 기간에는 1억 8,380만 달러에 달했다. 연구개발에 포함된 제조생산비는 전년 동기의 1,090만 달러에 대조적으로 2021년 3분기에 5,580만 달러에 달했으며 2021년 9월 30일을 종료 일자로 하는 9개월 기간에는 전년 동기 2,830만 달러 대비 1억 6,290만 달러를 기록하는 모습을 보였다. 제조생산비를 구성하는 요소에는 기술이전비용과 벌크형원료의약품(bulk drug substance, BDS) 및 완제의약품(drug product, DP)의 개시 및 생산 비용 등이 해당된다. 자사는 렌질루맙 BDS의 생산 및 DP 충전, 렌질루맙 공급망 구축을 위해 광범위한 위탁생산기관(CMO) 네트워크를 구축해오고 있다.
2021년 9월 8일, 미 FDA 측은 자사의 코로나19 입원 환자 대상 렌질루맙 치료제의 긴급사용승인(EUA)을 거부했다. 그에 따라 자사에서는 자사 특정 제조생산계약 중 일부는 취소하고 일부는 수정하였으며 그 중 일부는 EUA 결과에 따라 최종적인 결과가 결정될 것으로 이는 영국이나 유럽연합, 미국 등의 국가에서 승인을 취득하는 경우까지 렌질루맙 제조 생산에 투여될 향후 지출을 축소하기 위한 노력에서 비롯된 시도이다. MHRA나 EMA, FDA로부터 승인을 취득할 경우 자사에서는 상용화된 상품에 대한 수요가 2022년 한 해 동안의 기간을 대상으로 진행 중인 제조생산분량 및 계획된 제조생산분량을 초과할 것으로 예상한다. 자사에서는 승인을 획득할 경우 추가적인 제조 생산 역량을 갖추기 위한 방안을 모색하고자 한다. 2022년 이후의 제조 생산을 위해 자사는 자사의 CMO 역량을 갖춰야 할 것으로 예상하며 또한 필수적인 공급 및 부품을 확보해야 할 것으로 예상된다. 자사는 2023년과 그 이후의 제조 생산 역량을 확대하기 위한 자사의 노력을 뒷받침하기 위한 목적에서 규제 승인 획득 이후 발생하는 렌질루맙제의 상업적 판매에 따른 수익 일부를 활용할 예정이다.
자사의 CMO 일부는 이미 여러 가지 이유로 자사의 사양에 맞춘 렌질루맙의 일부 배치를 제조 생산하고자 시도했다가 실패한 경험이 있다. 해당 CMO 측이 제조 생산한 BDS 배치가 향후 사용 가능한지, 혹은 그렇지 않은 경우라면 자사에 별도의 금전적 보상을 제공할 수 있는지 그 여부를 파악하기 위해 자사는 해당 CMO와 협업을 이어갈 계획이다.
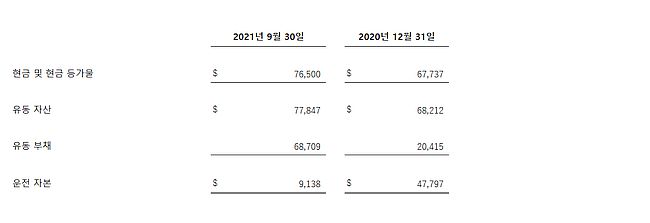
현금 및 현금 등가물
2021년 9월 30일을 종료 일자로 하는 3개월 동안의 영업 활동에 사용된 순 현금, 즉 대차대조표상 순 변동 금액은 4,800만 달러에 달하며 2021년 9월 30일을 종료 일자로 하는 9개월 동안의 동일 항목 금액은 1억 5,180만 달러에 달했다. 2021년 9월 30일을 종료 일자로 하는 9개월 동안 자사는 시장가 공모(At-the-Market offering)에 따른 보통주 지분 판매로 4,000만 달러의 순 수익을 올렸으며 헤라클레스 캐피탈(Hercules Capital)과의 신용 기관 하에 순 수익 2,440달러를 제공하는 동시에 2,500만 달러를 유치했고 보통주 공모를 통해 순 수익 9,420달러를 기록했다. 2021년 9월 30일 기준으로 자사는 총 7,650만 달러에 달하는 현금 및 현금 등가물을 보유하고 있는 상태이다. 2021년 9월 30일 이후 자사는 시장가 공모 프로그램 하에 약 2,450만 달러의 순수익을 확보했다.
2020년과 2021년 9월 30일을 종료 일자로 하는 3개월 및 9개월 동안의 주요 재무 상황 요약 내용은 다음과 같다. (단위: 1,000달러)
휴머니젠(Humanigen, Inc.) 개요
임상 단계 바이오제약사인 휴머니젠(Humanigen, Inc., Nasdaq: HGEN)은 사이토카인 폭풍(cytokine storm)이라고 불리는 면역 과민 반응을 예방하고 치료하는 데 주력하고 있다. 렌질루맙(Lenzilumab)은 과립구대식세포 증식인자(GM-CSF)와 결합해 이를 중화시키는 혁신 신약 항체다. 임상 전 모형 결과에 따르면 GM-CSF는 사이토카인 폭풍과 관련된 다수의 염증성 사이토카인과 케모카인의 상위 조절인자라는 사실을 알 수 있다. 코로나19 유행 초기에 이뤄진 연구에서는 T 세포를 분비하는 GM-CSF의 높은 수치가 발병도 및 중환자실(ICU) 입원과 상관관계가 있다는 결론이 나왔다. 휴머니젠의 라이브 에어(LIVE-AIR) 임상 3상 시험 결과, 렌질루맙을 조기에 투여받은 코로나19 입원 환자는 본격적인 사이토카인 폭풍을 피할 수 있는 것으로 나타났다. 휴머니젠은 향후 렌질루맙 치료제 마케팅 승인을 획득하기 위한 사전검토를 위해 영국 의약품규제청(MHRA)에 모든 자료를 제출한 상태이다. 휴머니젠은 CD19를 표적으로 하는 CAR-T 세포 치료법과 연관된 사이토카인 폭풍의 치료제로서 렌질루맙을 개발 중이며 알레르기성 조혈줄기세포이식(HSCT) 수술을 받은 환자들에게서 발생하는 급성 대숙주성 이식편명(GvHD)과 호산성 천식, 류머티즘 관절염 등 기타 염증성 질환에도 렌질루맙이 효과를 보일지 연구하고 있다. 더 자세한 정보는 휴머니젠 웹사이트와 링크트인, 트위터, 페이스북을 통해서 확인할 수 있다.
미래예측진술
이 보도자료에 포함된 모든 진술은 역사적 사실을 제외하고는 모두 미래예측진술에 해당한다. 미래예측진술은 미래 성과 혹은 사건에 대한 경영진의 현재 지식과 가정, 판단, 기대를 반영한다. 경영진은 그런 진술에 담긴 기대가 합리적인 것이라고 생각하지만, 기대가 현실로 실현된다는 보장은 없으므로 실제 상황이나 결과는 이들 미래예측진술의 내용과 크게 다를 수 있다는 점을 명심해야 한다. "될 것이다"와 "기대된다", "의도한다", "계획하다", "잠재적인", "가능성있는", "목표", "가속화하다", "이어가다", 이 외 유사한 표현으로 미래상황예측보고서가 구성되며 해당 보고서에는 특정 코로나19 입원환자 대상의 치료제로서 렌질루맙의 잠재적 이익에 대한 자사의 확신 및 영국 및 기타 국가에서 코로나19 치료에 렌질루맙을 사용하기 위한 자사의 조건부판매승인 신청 및 획득 노력, 판매 승인 획득 후 치료제로서의 렌질루맙제 필요에 관련된 자사의 신뢰 및 계획, 2022년 말까지 렌질루맙의 예상 공급에 대한 자사의 계획, 조건부판매승인 혹은 기타 판매 승인을 획득한 경우 영국 및 기타 시장에서의 렌질루맙 상용화를 위한 자사의 준비 효과, MHRA 혹은 EMA, FDA와 같은 규제 기관으로부터 판매 승인을 취득할 때까지의 미래 기간에 발생할 제조 생산 비용을 조절하기 위한 자사의 노력, 자사의 CMO 및 기타 서비스 제공인에게 유리한 조건으로 지불 관련 분쟁을 해결하는 자사의 역량, 계획된 임상 시험을 개시하거나 그에 참여하기 위한 자사의 기타 계획 내지 기타 염증 및 면역종양적 증상에 대한 치료법으로서 자사의 개발 포트폴리에서 렌질루맙 및 기타 후보 약제군의 효능을 파악하고자 하는 자사의 기타 계획 등을 포함한다.
미래예측진술은 회사의 수익성 부족과 사업 성장을 위한 추가 자본 필요성에 내재한 위험, 약물 후보 물질을 추가 개발하기 위한 파트너 의존성, 신약 출시 및 필수 규제 승인 또는 허가 및 획득과 개발에 내재한 불확실성, 렌질루맙과 같은 생물학 제재의 제조생산 및 상용화와 관련된 과제, 계류 중인 소송이나 미래 소송 결과, 휴머니젠이 미국 증권거래위원회(SEC)에 정기 제출하는 최신 연례 보고서 및 분기 보고서의 ‘위험요인’ 세션과 그 밖의 내용에 기술된 여러 위험 및 불확실성에 영향을 받지만 여기에 국한되지 않는다.
모든 미래예측진술에는 일체의 보장이 주어지지 않는다는 사실이 이 경고 언급을 통해 분명히 드러나 있다. 미래 사건을 예측할 때 미래예측진술에 의존해서는 안 된다. 각 상황에서 별도로 법에 의해 요구되지 않는 한 자사는 미래예측진술에 담긴 내용이 현시점 이후의 사건 혹은 상황을 반영하도록, 신규 정보 혹은 예측하지 못한 상황의 발생을 반영하도록, 실제 벌어진 상황이 미래예측진술의 예측과 다른 이유를 반영하도록 별도의 개정이나 내용 추가를 해야 할 의무를 지지 않는다.
참고 자료
1. SARS-CoV-2 변종 코로나19 바이러스 치료법 아그룹에 대한 유럽 전문가 집단(European expert group on SARS-CoV-2 variants, COVID-19 therapeutics sub-group). 코로나19 치료법 포트폴리오 – 가장 유망한 후보약제군 10종 목록(COVID-19 therapeutics portfolio – list of ten most promising candidates) (2021) 유럽집행위원회(European Commission) 2021년 10월 23일 열람, https://bit.ly/3CCtE4H
2. 영국 내 코로나19 현황 – 예방 접종(Coronavirus (COVID-19) in the UK – Vaccinations) (2021년 10월 27일). 2021년 10월 28일 열람, https://coronavirus.data.gov.uk/details/vaccinations.
3. Goldberg, Y. 등 공저. (2021). 이스라엘 내 BNT162B2 백신 접종 후 면역력 저하 현상(Waning immunity after the BNT162B2 vaccine in Israel). 뉴잉글랜드의학저널(New England Journal of Medicine). https://doi.org/10.1056/nejmoa2114228
4. 영국 내 코로나19 현황 – 입원 환자(Coronavirus (COVID-19) in the UK – Hospital Admissions) (2021년 10월 27일). 2021년 10월 28일 열람, https://coronavirus.data.gov.uk/details/healthcare.
5. 영국 보건안전국(UK Health Security Agency), 코로나19 백신 접종 추이 보고서 43주차(COVID-19 vaccine surveillance report Week 43) (2021년 10월 28일). 2021년 11월 1일 열람, https://bit.ly/3cCECwp
Humanigen Investor Relations
Ken Trbovich
Humanigen
trbo@humanigen.com
650-410-3206
Copyright 2021 ACN Newswire. All rights reserved. www.acnnewswire.com