
HONG KONG, Feb 16, 2022 - (亚太商讯) - 中国抗体制药有限公司(“中国抗体”或“公司”,连同其附属公司,统称“集团”;股份代号:3681.HK),专注研究、发展、制造及商业化免疫性疾病疗法的香港生物制药公司,欣然宣布于二零二二年二月十一日(美国东部当地时间),公司已就用于哮喘的第一类(First-in-Class)治疗产品 SM17(注射用人源化抗 IL-17RB 单克隆抗体)提交新药研究申请(“IND”),有关申请已获美国食品药品监督管理局 (U.S. Food and Drug Administration,“FDA”)受理。公司计划一旦新药研究申请获 FDA 批准,最早于二零二二年第一季度在美国启动首次人体临床研究。
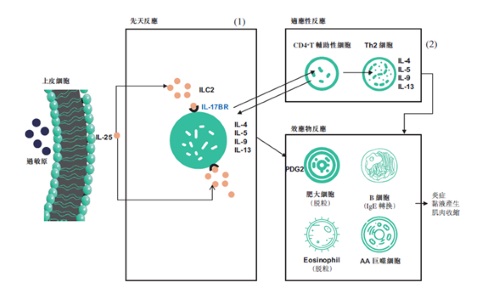
SM17的作用机制
SM17,是中国抗体与剑桥大学合作、全球首创针对IL17BR靶点的单抗药物,所覆盖的适应症较为多元,既能针对哮喘这类市场体量巨大的适应症,也能治疗特发性肺纤维化这类致死率高的疾病,相较于已知的其他在售药物,在源头上已具备差异化优势。SM17的临床前数据和独特的作用机制使我们相信SM17可能比其他获批准的生物制剂对哮喘治疗有更广泛和更有利的作用。
在全球市场上,哮喘患者的数量正在逐渐增加,预计在二零二三年将达到2.475亿,并在二零三零年进一步增加到2.677亿。而中国的哮喘患者数量的增长速度高于全球增长率,预计在二零二三年将达到2,560万,并在二零三零年进一步增加到2,780万。从市场规模上,预期全球哮喘产品市场于二零二三年前将达到251亿美元,于二零三零年前将达到 346亿美元。而中国哮喘产品市场将预期于二零二三年前将达到人民币364亿元,于二零三零年前将达到人民币650亿元。从治疗方案上,传统哮喘治疗以吸入皮質類固醇为主,但易产生严重的不良反应,特别是对青少年。长期使用还会产生耐药性。SM17的推出,有望在有效性和安全性的平衡上提供更佳的治疗方案。
中国抗体主席、执行董事兼首席执行官梁瑞安博士表示:“继公司早前公布SN1011新药研究申请(针对多发性硬化症)获中国国家药品监督管理局药品审评中心受理后,本次SM17新药研究申请获FDA受理,充分反映公司推展新药研发项目的高效执行力。目前严重哮喘的有效治疗仍存在未满足的医疗需求,尤其是对当前疗法无应答的患者而言,我们对 SM17 巨大的临床开发前景充满信心。公司多款核心产品,包括SM03、SN1011及SM17的临床研发顺利推进,意味着公司正稳步向实现商业化目标前进。未来我们将加快推进项目,通过产品创新,为患者谋求福祉、为股东创造价值。”
关于SM17
SM17是已知全球首创用于新药开发, 针对IL-17BR靶点的人源化IgG4-κ单克隆抗体。IL-17RB属于IL-17受体家族的一种I型单跨膜糖蛋白。SM17 结合IL-17RB 后,可抑制由一类被称为“警戒素”的细胞因子导致的 Th2 细胞相关免疫反应,而“警戒素”已被证明与过敏性疾病的病理过程及气道细胞的病毒感染反应有关。作为哮喘治疗的新路径,靶向 Th2 炎性细胞因子通路上游介质(例如“警戒素”)的疗法,预计将对气道炎症相关的病理变化产生更广谱的作用,从而较现有疗法更为有效地控制哮喘症状。目前已有针对“警戒素”相关信号通路,与 SM17 具有相若作用机制的严重哮喘疗法获FDA批准。
关于中国抗体制药有限公司
中国抗体制药有限公司专注于研究、发展、制造及商业化免疫性疾病疗法。公司注重科技研发,其旗舰产品SM03为全球首项用以治疗类风湿关节炎的潜在抗CD22单抗,已在中国进入类风湿关节炎三期临床试验,并被列为国家十三五重大新药创制专项重大项目。此外还有多个同类靶点首创(First-in-target)及同类首创(First-in-class)在研药物,部分已处于临床阶段,适应症覆盖类风湿性关节炎、系统性红斑狼疮、寻常型天疱疮、非霍奇金氏淋巴瘤、哮喘等具有重大未满足临床需求的疾病。
Copyright 2022 亚太商讯. All rights reserved. www.acnnewswire.com